上海首个获批的新冠抗原检测产品诞生,四部门联手推动上市
本文转自:上观

文章图片
文章图片
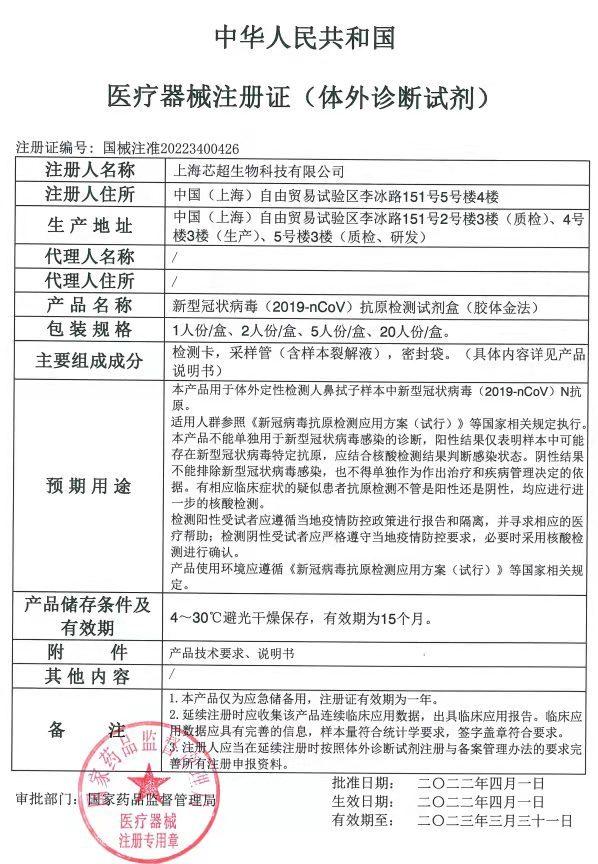
今天 , 上海首个获得我国医疗器械注册证的新冠抗原检测产品诞生 , 上海芯超生物科技有限公司研发的新型冠状病毒抗原检测试剂盒(胶体金法)获得国家药监局注册证 。在市科委、市药监局、市经济信息化委和市卫生健康委支持下 , 芯超生物团队半个月来通宵达旦工作 , 终于走完了注册证申报流程 , 让沪研、沪产新冠抗原检测产品进入国内市场 。
文章图片
文章图片
3月11日 , 国家卫生健康委印发《新冠病毒抗原检测应用方案(试行)》 , 推进“抗原筛查、核酸诊断”监测模式 , 增加抗原检测作为核酸检测的补充手段 。方案发布后 , 上海市科委、市药监局、市经济信息化委和市卫生健康委立即组建了工作专班 , 采用日报制度、挂图作战方式 , 重点推进芯超生物、之江生物、科华生物、复星诊断和伯杰医疗等5家企业的新冠抗原检测产品注册证申报工作 , 以最快速度完成临床试验、生产协同、材料报批等工作 。
目前 , 芯超生物走在了最前面 。这家企业是生物芯片上海国家工程研究中心下属单位 , 2020年4月 , 公司研发的新型冠状病毒抗体检测试剂盒(胶体金法)通过国家药监局应急审批 , 成为上海唯一获批的新冠抗体检测试剂盒 。同年 , 这家企业研发的新冠核酸、抗体、抗原及中和抗体检测试剂盒均获得欧盟CE认证 , 并进入中国医保商会出口白名单 。
我国新冠抗原检测应用方案发布后 , 抗原检测产品已得到欧盟认可的芯超生物迅速响应 , 立即组建攻关团队 。生物芯片上海国家工程研究中心主任、芯超生物总经理郜恒骏教授领衔 , 芯超生物副总经理张小燕博士带领研发团队、注册部、临床试验、后勤保障等部门夜以继日工作 。经过近半个月奋战 , 这款名为“芯赛新”的抗原检测试剂盒进入了国家药监局的新冠应急医疗器械审批通道 , 通过中检所注册检验 , 并完成了国内临床试验 。

文章图片
文章图片
据介绍 , “芯赛新”新冠抗原检测试剂盒包含取样拭子、采样管(含裂解液)、检测卡、生物危害袋等 , 可用于个人居家自测 , 经国内外大量样本验证 , 灵敏度和特异性优异 。

文章图片
文章图片
抗原检测和核酸检测原理不同 。简而言之 , 核酸检测采用的是分子生物学原理 , 对病原体的核酸序列进行逆转录、扩增和定性检测 , 灵敏度和特异性较高 , 成本也较高 。抗原检测采用的是免疫学原理 , 可在非实验室环境中较快完成检测 , 灵敏度和特异性比核酸检测差 。因此 , 抗原检测可作为核酸检测的补充手段 。
【上海首个获批的新冠抗原检测产品诞生,四部门联手推动上市】郜恒骏介绍 , 新冠抗原检测在一些国家已应用两年有余 , 实践证明 , 对于有发烧、咳嗽等症状的患者 , 抗原检测敏感性很高 。这与病毒传染性较强时 , 抗原产品更易检测出来这一特性完全符合 。
- 疫情下,这个上海科技企业致力将人工从繁复的流动信息填报中解放出来
- 探索“大脑森林”奥秘,上海科研团队建立小鼠神经联接数据库
- 天津首个跨境电商进口退货中心仓正式启用
- 武汉天地壹方南馆成为湖北首个获碳中和认证商场
- 不用跟人抢车位了!北京首个线上预约停车服务开通
- 上海清明节疫情防控政策在哪看(2022上海清明节防控政策微信查看步骤详解)
- 这家上海初创企业成立3个月就完成数亿元融资,如今还找来这个牛人……
- 撑起“云上海”“云民生”,上海电信打赢“云端抗疫战”
- 国内首个全屋智能行业白皮书发布:竞争将回归至服务本身
- “环球艺术市场报告”出炉:上海品牌艺博会成为领头羊
